2024-06-25 東京大学
発表のポイント
- 牛伝染性リンパ腫ウイルス(BLV)のlong terminal repeat(LTR)領域と宿主遺伝子(BoLA-DRA遺伝子)をリアルタイムPCR法により同一のウェルで同時に検出し、細胞数あたりのウイルス遺伝子量を正確に測定可能な簡易・迅速ウイルス遺伝子定量法を確立し、その乾燥試薬を世界で初めて開発しました。
- これらの新規診断法は、既存法と同程度の検査精度、分析感度 (検出限界)、および診断感度と特異度を示し、既存法と同様にウイルス遺伝子を定量できることが明らかになりました。
- 本研究成果は、検査作業の負担、時間およびコストが軽減されるだけでなく、室温での輸送や保管が可能となることから、全世界に蔓延しているBLVの清浄化対策に大きく貢献できることが期待されます。

概要
間特任教授を研究代表とする東京大学大学院農学生命科学研究科、株式会社ニッポンジーン、兵庫県食肉衛生検査センター 淡路食肉衛生検査所、埼玉県熊谷家畜保健衛生所の4者からなる研究グループは、牛伝染性リンパ腫ウイルス簡易迅速定量法BLV-CoCoMo Dual qPCR法とその乾燥試薬の開発に世界で初めて成功したことを「Viruses」に発表しました。
現在、牛伝染性リンパ腫ウイルス(BLV)(注1)感染は全世界に拡大し続けており、畜産業に甚大な経済的被害をもたらしています。特に、感染率が高い農場において単純に感染牛を隔離・淘汰するという戦略は難しくなっており、高度に蔓延したBLVの感染率を低下させるためには、病態進行やウイルス伝播リスクの指標となるBLVウイルス遺伝子量を定量可能な遺伝子検査の役割がますます重要になっています。
東京大学大学院農学生命科学研究科の間特任教授らおよび株式会社ニッポンジーンは、検査作業の労力、時間およびコストの削減を狙い、BLVウイルス遺伝子と宿主遺伝子を同一のウェルで同時に検出し、細胞数あたりのウイルス遺伝子量を正確に測定可能なBLV-CoCoMo Dual qPCR法 (Dual-CoCoMo法) を開発しました。このDual-CoCoMo法に使用する試薬と反応条件を最適化することで、定量値や測定精度が既存法と同等になることを明らかにしました。そして、さらなる作業の負担軽減と効率化を図り、Dual-CoCoMo法の乾燥試薬を世界で初めて開発しました。本乾燥試薬は、既存法と同等の診断感度および特異度を示し、これまでと同じ測定精度でウイルス遺伝子量を簡便かつ迅速に定量できることを明らかにしました。本新規診断法は、全世界に蔓延しているBLV清浄化対策に大きく貢献できることが期待されます。
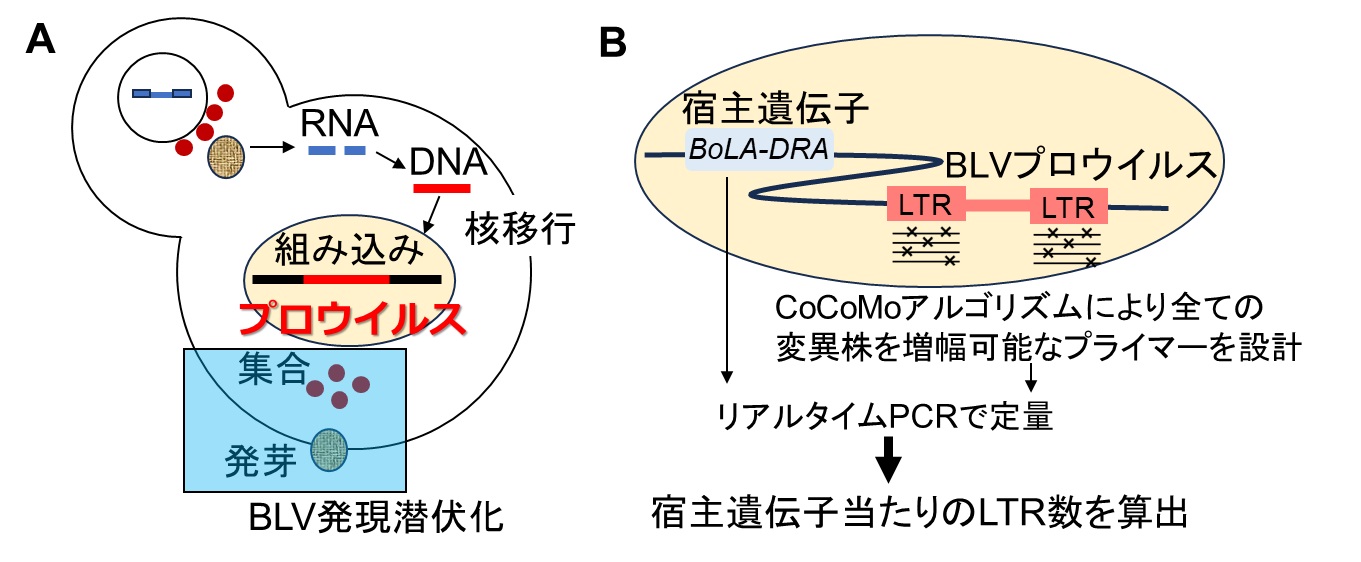
図1 BLVの生活環とBLV-CoCoMo-qPCR法の原理
(A) BLVは感染細胞から主にCell to Cellにより移入され、逆転写酵素によりウイルスRNAからDNAに逆転写し、宿主の染色体に組み込まれてプロウイルスとなり、一生涯体内に存在し続ける。その後、ウイルス遺伝子の転写が起こり、ウイルスタンパク質が集合した後発芽するが、BLVはウイルス転写が強く抑制されているため抗原の発現はほとんど見られない。(B) プロウイルスは2つのlong terminal repeat(LTR)領域(注2)を有している。LTR遺伝子配列の変異により定量性が得られなくなることを防ぐ目的で、CoCoMoアルゴリズムを用いた既知および未知を含めた全てのBLV変異株を増幅可能な縮重プライマーを設計した。宿主遺伝子のBoLA-DRA遺伝子を同時に検出することで細胞当たりのコピー数を正確に算出することが可能となる。
発表内容
BLVは、悪性Bリンパ腫である地方病性牛伝染性リンパ腫(EBL)を惹起するレトロウイルスです。現在、有効な治療法やワクチンは実用化されておらず、農家に多大な経済的被害をもたらしています。BLVに感染すると約70%が未発症健康牛、約30%が持続性リンパ球増多症となり、5~10年と長い潜伏期間を経て、約2~5%のウシがリンパ腫を発症し、発症牛は全廃棄となります。BLVは、逆転写酵素によりRNAからDNAに逆転写され、宿主染色体へ組み込まれてプロウイルスとなります (図1A)。ウイルスの発現は感染後一過性に上昇した後に潜伏化するため、BLVの感染はウイルスmRNAやタンパク質の発現ではなく、宿主染色体へ組み込まれたプロウイルスの有無で診断することが必要です。これまでの研究において、プロウイルス量と病態進行は相関し、プロウイルスが病態進行のマーカーとなることが明らかになっていることから、ウイルスの検出および感染の進行を表す指標として宿主ゲノムに組み込まれたプロウイルス量の定量が重要となります。
これまでに間特任教授らは、BLVウイルス遺伝子量定量法としてBLV-CoCoMo-qPCR法 (Single-CoCoMo法) を開発し、現在、共同研究先である株式会社ニッポンジーンより検査試薬が販売されています。本手法はリアルタイムPCR法(注3)で、BLVのLTR領域にCoordination of common motif (CoCoMo) アルゴリズムにより未知を含めた全てのBLV変異株を検出可能な縮重プライマーセットと、特異性担保のために保存された領域を標的とするFAM蛍光色素標識TaqMan MGBプローブを用い、さらに宿主因子BoLA-DRA遺伝子を標的とするFAM蛍光色素プローブを用いて別ウェルで測定することで、細胞数あたりのプロウイルス量を正確に測定することができます (図1B)。そこで、本研究では、このSingle-CoCoMo法の検査作業の労力、時間およびコストの削減を狙い、同一反応ウェル内で2つの遺伝子を検出可能なDual-CoCoMo法を開発しました(図2)。
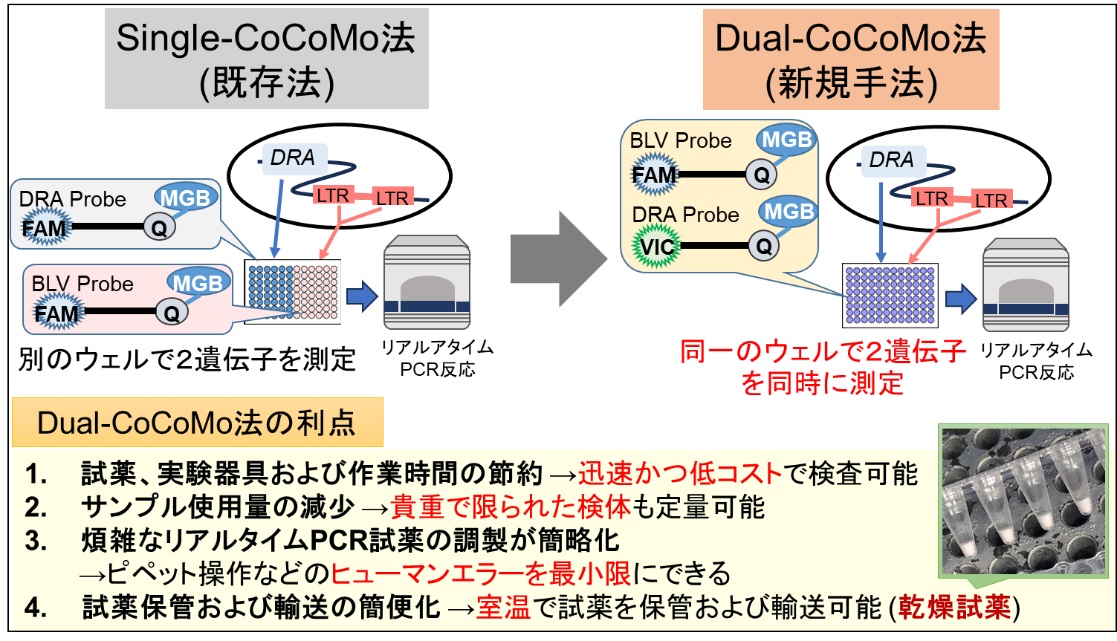
図2 Dual-CoCoMo法の原理と利点
既存Single-CoCoMo法では、FAM蛍光色素を修飾したMGBプローブを用いて、2つの遺伝子を別のウェルで検出することでプロウイルス量を定量する。一方で、Dual-CoCoMo法は、既存プローブ配列の5’末端にFAMもしくはVIC蛍光色素を修飾したMGBプローブを作製し、同一のウェルで2つの遺伝子を同時に検出してプロウイルス量を定量する。
まず、既存Single-CoCoMo法に基づき、BLV LTR領域とBoLA-DRA遺伝子を同時に検出可能なFAM蛍光色素あるいはVIC蛍光色素標識MGBプローブを作製し、Dual-CoCoMo法に最適な定量PCR試薬と条件を検討しました。定量PCR試薬として、ニッポンジーン社製GeneAce Probe qPCR Master Mix II (GeneAce) を含む2種類の酵素を検討したところ、GeneAce qPCR試薬を使用したDual-CoCoMo法では、Single-CoCoMo法と同程度の定量値と測定誤差であったことから、Dual-CoCoMo法は既存法と同等の測定精度でウイルス遺伝子量を定量できることが示されました。次に、間特任教授らおよび株式会社ニッポンジーンは、さらなる作業の負担軽減および効率化を図り、BLV遺伝子検査薬では世界で初めてとなるDual-CoCoMo法の乾燥試薬を開発しました。この乾燥試薬は、測定に必要な試薬を全て反応チューブに乾燥させているため、試薬を溶かすだけでウイルス遺伝子量を定量することが可能となり、3つの作業工程((1)滅菌水の添加、(2)ゲノムDNAの添加、(3)定量PCR反応と解析)のみでウイルス遺伝子量を定量することができます。また、室温保存が可能であるため、試薬の保存や輸送も簡便になります。そこで、液体試薬を用いたDual-CoCoMo法 (Liquid Dual-CoCoMo法) と乾燥試薬を用いたDual-CoCoMo法 (Dry Dual-CoCoMo法) の検査性能を評価するため、(1)BLV感染性分子クローンpBLV-IF2を用いた分析感度(検出限界)、(2)野外牛を用いた診断感度と特異度、および(3)Single-CoCoMo法で定量したウイルス遺伝子量との相関性を調べました。その結果、Liquid Dual-CoCoMo法とDry Dual-CoCoMo法を用いた分析感度、診断感度および特異度はSingle-CoCoMo法と同程度であることが示されました。また、これら2つのDual-CoCoMo法とSingle-CoCoMo法との相関分析を行ったところ、それぞれ両者の間に強い正の相関が認められ (図3)、既存Single-CoCoMo法と同じ測定精度でプロウイルス量を簡便に定量できることが明らかとなりました。
本研究で開発した液体試薬および乾燥試薬を用いたDual-CoCoMo法は、(1)試薬、実験器具および作業時間の節約、(2)サンプル使用量の減少、(3)煩雑なリアルタイムPCR試薬の調製が簡略化、(4)試薬乾燥化により試薬保管および輸送の簡便化が実現できることから、国内だけでなく全世界に蔓延しているBLVの清浄化対策に大きく貢献できることが期待されます。
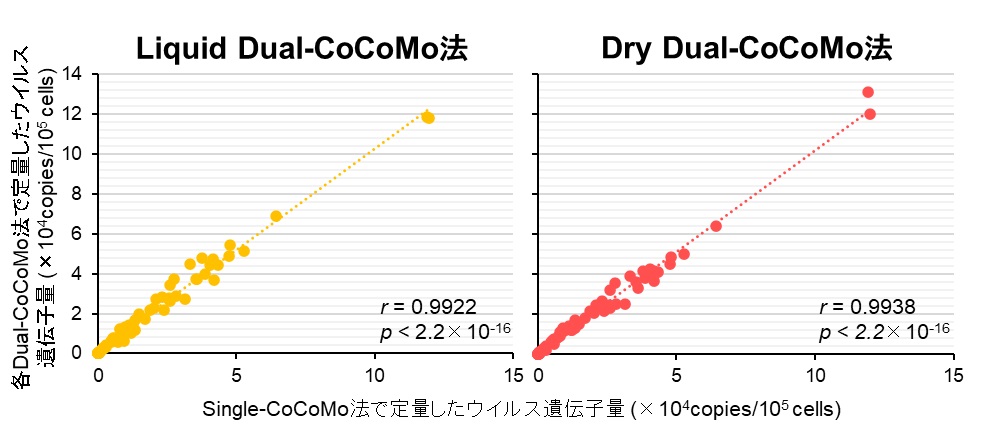
図3 Single-CoCoMo法と各Dual-CoCoMo法のウイルス遺伝子量の相関性
各手法を用いて71頭の感染牛のウイルス遺伝子量を定量した。Liquid Dual-CoCoMo法またはDry Dual-CoCoMo法で測定したウイルス遺伝子量とSingle-CoCoMo法で測定したウイルス遺伝子量の相関性をピアソンの相関係数 (r) を用いて評価し、p値はグラフ中に示した。
発表者・研究者等情報
東京大学大学院農学生命科学研究科農学国際専攻
綿貫 園子 博士課程
叶 穎宝 修士課程
包 阿荣高娃 博士課程
河鰭 実之 教授
劉 宇琳 修士課程
松本 安喜 教授
間 陽子 特任教授
株式会社ニッポンジーン
庄司 和幸 分子診断試薬部 係長
伊澤 真樹 分子診断試薬部 部長
大上 光明 診断試薬部 部長
兵庫県食肉衛生検査センター 淡路食肉衛生検査所
齋藤 恵津子 食肉検査専門員
埼玉県熊谷家畜保健衛生所
杉山 公一 家畜防疫担当 主任
遠藤 みちる 家畜防疫担当 技師
発表雑誌
- 雑誌
- 「Viruses」(2024年6月25日)
- 題名
- Development of a dry- and liquid-duplex-reagent mix‑based polymerase chain reaction assay as a novel tool for the rapid and easy quantification of bovine leukemia virus (BLV) proviral loads
- 著者
- Sonoko Watanuki, Kazuyuki Shoji, Masaki Izawa, Mitsuaki Okami, Yingbao Ye, Aronggaowa Bao, Yulin Liu, Etsuko Saitou, Kimikazu Sugiyama, Michiru Endo, Yasunobu Matsumoto, Yoko Aida※ ※責任著者
- DOI
- 10.3390/v16071016
- URL
- https://www.mdpi.com/1999-4915/16/7/1016
研究助成
本研究は、株式会社ニッポンジーンとの共同研究費、日本中央競馬会畜産振興事業費、科研費「特別研究員奨励費(課題番号: 23KJ0412)」の支援により実施されました。
用語解説
注1 牛伝染性リンパ腫ウイルス
BLV (bovine leukemia virus)と呼ばれる。悪性Bリンパ腫である地方病性牛伝染性リンパ腫を引き起こすレトロウイルスである。
注2 long terminal repeat (LTR)領域
同じ配列が数百から数千回繰り返す DNA 配列でレトロウイルスRNAが逆転写されて生じるプロウイルス DNAの両端にみられる。
注3 リアルタイムPCR法
ポリメラーゼ連鎖反応 (polymerase chain reaction, PCR)は、デオキシリボ核酸 (Deoxyribonucleic acid, DNA) を増幅する方法である。リアルタイムPCR法とは、このPCRによる増幅をリアルタイムでモニターし、定量的に測定する方法である。
問い合わせ先
東京大学大学院農学生命科学研究科
特任教授 間 陽子(アイダ ヨウコ)
株式会社ニッポンジーン
診断試薬部 企画開発課