生物学的製剤による医療診断に有効な標識・複合化試薬を開発
2018年2月23日 理化学研究所
要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典主任研究員と藤木勝将特別研究員の研究チームは、タンパク質や細胞などの表面に対する標識基での標識、さらに糖鎖などの生体機能性分子との複合化を効率的に行うことができる試薬を開発し、「理研クリック試薬」と名付けました。
がんなどの標的細胞に発現する特定の分子に対して高い親和性を持つペプチド、タンパク質、抗体、細胞を代表とする生物学的製剤が疾患の診断や治療に利用されています。生物学的製剤は、化学的な合成ではなく生物が作る薬剤であり、標識基(蛍光基や放射線放出核種など)で標識したり、抗がん物質を結合させたりして使用します。現在、標識には活性エステル法[1]が利用されていますが、水中での反応性に乏しいという問題があります。最近では、遺伝子工学と有機化学反応を併せた方法も検討されていますが、どのような検体に対しても簡便かつ迅速に利用できる汎用的な方法はありませんでした。
研究チームは2010年、独自に見出した「高速6π-アザ電子環状反応(理研クリック反応)[2]」を利用し、共役アルデヒド構造を持つ試薬でペプチド、タンパク質、生細胞の表面に対して、それらの機能を損なうことなく蛍光基や放射線放出核種で標識することに成功し報告しました注1)。また、標識したペプチドなどの動物生体内での動態を蛍光イメージング[3]や陽電子放出断層撮影法(PET)[4]で追跡し、生物学的製剤に特有の排出過程や臓器選択的な集積を明らかにしました。2016年には同試薬を使って糖鎖などの生体機能性分子をタンパク質や生細胞表面に導入、複合化し、新しい機能を持つ人工生物学的製剤の開発にも成功しました注2、3)。さらに、2017年には放射線内用療法[5]や抗体ミサイル療法[6]に有効な抗体へのβ線放出核種標識技術も提供しています。
今回、これらの成果をもとにタンパク質や細胞などの表面に対する標識基での標識、さらに糖鎖などの生体機能性分子との複合化を効率的に行うことができる「理研クリック試薬」の開発に成功し、この試薬が生物学的製剤への新しい標識・複合化試薬として、『有機合成用試薬百科事典』に選出・発表されました。
今後、理研クリック試薬が化学者、生物学者、医療現場に携わる研究者に広く周知されることで、医療診断分野の発展に貢献すると期待できます。
本試薬の詳しい調製法、特性、使用法、適応範囲はドイツのオンラインデータベース『Encyclopedia of Reagents for Organic Synthesis (e-EROS)』に近日掲載予定です。
注1)2010年4月19日プレスリリース「生きた細胞を簡便に数分程度の化学反応で蛍光標識することに成功」
注2)2016年2月23日プレスリリース「生体内部を高度に認識できる糖鎖複合体」
注3)2016年11月28日プレスリリース「糖鎖は不均一であることが重要-糖鎖特有の分子認識機構をマウスで証明-」
背景
現代のライフサイエンス分野における最重要課題の一つは、がんに代表されるさまざまな疾患を早期に発見し治療する方法の開発であり、国内外の大学、研究機関、製薬企業、医療機関で盛んに研究されています。
疾患を発見する方法の一つに、がんなどの標的細胞に発現する特定の分子に対して高い親和性を持つ「生物学的製剤」を用いる手法があります。生物学的製剤は化学的な合成ではなく生物によって作られる薬剤で、ペプチド、タンパク質、抗体、細胞がその代表です。この手法では、生物学的製剤に対して蛍光基や陽電子放出核種、常磁性核種で標識し、蛍光イメージングや陽電子放出断層撮影法(PET)、核磁気共鳴画像法(MRI)[7]で、高感度かつ非侵襲的(生きたまま)に疾患部位を検出します。さらに診断結果をもとに、放射線内用療法、抗体ミサイル療法などの治療が行われています。
現在、生物学的製剤の標識にはスクシンイミジルエステル化合物を使用する活性エステル法が用いられていますが、水中での反応性に乏しいという問題がありました。最近では、遺伝子工学やクリック反応[8]などの有機化学反応を併用する手法が検討されていますが、診断や医療現場に利用できる簡便で迅速な方法とはまだいえません。このように、生物学的製剤に対してその機能を損なわずに、温和な条件下で短時間にさまざまな蛍光基や放射性核種で標識する汎用的な手法はありませんでした。
研究チームは2010年、独自に見出した「高速6π-アザ電子環状反応(理研クリック反応)」を利用し、共役アルデヒド構造を持つ試薬でペプチド、タンパク質、生細胞の表面に対して、それらの機能を損なうことなく蛍光基や放射線放出核種で標識することに成功し報告しました。また、標識したペプチドなどの動物生体内での動態を蛍光イメージングやPETで追跡し、生物学的製剤に特有の排出過程や臓器選択的な集積を明らかにしました。2016年には、この試薬を使って糖鎖などの生体機能性分子をタンパク質や生細胞表面に導入し、新しい機能を持つ人工生物学的製剤の開発にも成功し報告しています。さらに、2017年には、放射線内用療法や抗体ミサイル療法に有効な、抗体へのβ線放出核種標識技術を提供しています。
そこで研究チームはこれらの成果をもとに、生物学的製剤に対して誰もが簡便に標識や複合化を行える汎用的な試薬の開発を目指しました。
研究手法と成果
研究チームは、共役アルデヒド構造を持つ海産天然物を研究する過程で、理研クリック反応により、共役アルデヒドとアミノ基(-NH2)の高速な結合反応が生体内でも起きていることを見出しました。
今回開発した「理研クリック試薬」の原型となる共役アルデヒドをリジン(アミノ酸)やエタノールアミンなどの一級アミン(R-NH2)に作用させると、共役イミン[9]が形成されます。すると、理研クリック反応が高速で進行し、一級アミンとの共有結合が形成され、環状のピリジン誘導体が生成されます。このとき、中間に生じる共役イミンの適当な位置に、共役系置換基(ベンゼン環など)と電子求引基(-CO2Etなど)を導入することにより共役イミンが活性化され、理研クリック反応が著しく促進されることを発見しました(図1)。
研究チームは今回、理研クリック反応の元となる共役アルデヒドに着目しました。そして、この共役アルデヒドに蛍光基や陽電子放出核種、がん治療への期待が高まっているβ線放出核種、さらに常磁性核種などの標識基を導入することにより、理研クリック反応を経た生物学的製剤の標識法を確立し、標識した共役アルデヒドを「理研クリック試薬」と名付けました。
理研クリック試薬は、数ナノグラム(ng、1ngは10億分の1グラム)のペプチドやタンパク質に作用させることで、生物学的製剤に対してさまざまな標識基で標識できます。また、理研クリック試薬の濃度を調節することにより、生物学的製剤の活性を損なうことなく、定量的に標識できます。この方法はペプチドやタンパク質だけでなく生細胞に対しても適用でき、10ナノモル(nM、1 nMは10億分の1モル)レベルの理研クリック試薬を室温で数分間(長くても30分以内)作用させるだけで、これまでに報告されている中で最も効率的に細胞表面のアミノ基をさまざまな標識基で標識できました(図2上段)。
続いて、理研クリック試薬を利用して、従来困難とされてきた生物学的製剤の汎用的な蛍光イメージング、PETイメージングなどを理研ライフサイエンス技術基盤研究センターの渡辺恭良センター長と共同で実現しました。まず、理研クリック試薬を使った陽電子放出核種(68Ga-DOTA)で、ウサギとマウスのソマトスタチンペプチド(成長ホルモンの分泌抑制作用などを持つホルモン)を標識しました。その結果、ウサギとマウス間でのソマトスタチンペプチドの代謝過程の相違(図2a)をPETイメージングすることに成功しました。続いて、理研クリック試薬を使って68Ga-DOTAで、糖鎖の端にシアル酸がある「シアロ糖タンパク質」とシアル酸がない「アシアロ糖タンパク質」をそれぞれ標識しました。その結果、ウサギにおいて糖タンパク質製剤の糖鎖構造に依存するタンパク質の排出過程や臓器選択的な集積(図2b)をPETイメージングすることに成功しました。さらに、理研クリック試薬を使って蛍光色素で、リンパ球と胃がん細胞の表面をそれぞれ標識しました。その結果、マウス体内でのリンパ球の動態(図2c)と、マウスの胃がん細胞の糖鎖表面構造ががんの転移に及ぼす影響(図2d)を蛍光イメージングすることにも成功しました。
さらに最近では、理研仁科加速器研究センターの羽場宏光チームリーダー、上垣外修一部長と共同で、β線放出核種である67Cuを用いて抗体を効率的に放射線標識することに成功し、放射線内用療法や抗体ミサイル療法に有効な標識技術を提供しています。
さらに研究チームは、この技術を生物学的製剤と糖鎖を代表とする生体機能性分子との複合化法として展開しました。タンパク質や細胞表面のアミノ基に対して、理研クリック試薬を作用させることにより、さまざまな糖鎖を導入することができ、複合化を実現しました。また、2種類以上の異なる糖鎖の構造を一挙に導入することもでき、生体内での選択的な認識や特異的な機能を持つ天然糖鎖の「クラスター環境」を初めて擬似化することが可能となりました。この結果、標的の臓器、がん、あるいは特定の疾患に対して、高度な認識を可能とする糖鎖複合体、さらに膀胱や胆嚢を経た排出を選択的に制御できる糖鎖複合体を作製することに成功しました(図3)。
今後の期待
研究チームが開発した理研クリック試薬により、これまで遺伝子工学的手法を用いなければ不可能であった、生物学的製剤や細胞をそのまま標識することで生体内での解析を実現しました。また、理研クリック試薬により調製できる糖鎖複合体は、医療診断分野に新しいドラッグデリバリーシステム[10]として、大きなインパクトを与えます。
研究チームは、理研クリック試薬を有機合成化学者のみが行える特殊な標識法として展開するのではなく、生物学や医療診断分野に携わる研究者の誰もが活用できる汎用的なキットとして多くの研究者に提供しました。今後、タンパク質、抗体、糖鎖複合体の動態解析や放射線治療、あるいは創薬過程で生物学的製剤や細胞治療の効率性を評価する次世代基盤技術としての貢献が期待できます。
原論文情報
Katsumasa Fujiki and Katsunori Tanaka, “RIKEN Click Reagent for Protein Labeling”, Encyclopedia of Reagents for Organic Synthesis (e-EROS)
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典 (たなか かつのり)
特別研究員 藤木 勝将 (ふじき かつまさ)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- 活性エステル法
- カルボン酸の活性エステルの一つであるスクシンイミジルエステル化合物で、ペプチドやタンパク質のアミノ基を標識する方法。
-
- 高速6π-アザ電子環状反応(理研クリック反応)
- 1-アザトリエンの末端炭素原子と窒素原子が結合してピリジン誘導体を与える反応を6π-アザ電子環状反応と呼ぶ。この反応は古くから知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率もよくなかったことから積極的に合成法として活用されることは少なかった。しかし1998年に発表者らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、「理研クリック反応」として、理研を中心とした国際研究グループが中心となり診断や放射線治療に向けた研究を展開している。
-
- 蛍光イメージング
- 目的の化合物に蛍光色素を付けた後、細胞内、あるいは動物の体内に導入することにより、その化合物が発する蛍光を指標として、生体内での動きを観察(イメージング)すること。本研究で示した動物内での蛍光イメージングでは、動物の厚い皮膚に対して光を透過させ、生体内にもともと存在する物質から発するさまざまな蛍光に邪魔されることのない、近赤外領域(750nm以上が望ましい)に吸収を持つ蛍光色素を用いた。
-
- 陽電子放射断層撮影法(PET)
- ごく微量の放射線(陽電子、ポジトロン)を出す放射性核種を薬などの分子に組み込み(PETプローブ)、そこから出る放射線を測定し、薬が体内のどこにあるかを観察する方法。フッ素(18F:半減期110分)や炭素(11C:半減期20分)はPETで測定可能な放射線を出す原子で、これらは標識基として使われる。また生物学的製剤には、ガリウム(68Ga:半減期68分)や銅(64Cu:半減期13時間)などの陽電子を放出する金属を配位させた金属錯体が導入される。PETはPositron Emission Tomographyの略。
-
- 放射線内用療法
- β線やα線を放出する放射線放出核種を体内に導入し、悪性腫瘍に対する放射線治療を行うこと。
-
- 抗体ミサイル療法
- 放射線内用療法の中でも、がんに集積する抗体などに放射線放出核種を組み込み、がんを選択的に殺傷する方法。B細胞性非ホジキンリンパ腫やマントル細胞リンパ腫に対する薬剤である90Y標識イブリツモマブ(抗CD20抗体、ゼヴァリン)などが知られる。
-
- 核磁気共鳴画像法(MRI)
- 磁気と電磁波、それに水素原子の動きを利用して、主に身体の解剖学的な情報を得る技術。水素原子には磁気に反応する性質があるため、磁場を作る装置の中で体に電磁波を当てると、体内の水素原子が反応して信号を発する。その信号を捕えてコンピュータで解析し画像にする。生物学的製剤のイメージングにおいては、フッ素(F)、あるいは近傍の水の緩和に影響を与えるガドリニウム(Gd)金属を配位させた金属錯体を導入して行われる。MRIはMagnetic Resonance Imagingの略。
-
- クリック反応
- スクリプス研究所のB. K. Sharpless教授(2001年ノーベル化学賞受賞)によって提起された効率的な結合形成反応。シートベルトを締める際、“カチッ”というように、2つの反応部位が、速やかに、かつ選択的に、しかも他の副生成物を与えることなく100%に近い効率で結合生成を起こすような型の反応をいう。この代名詞として、アジドとアセチレン(炭素−炭素三重結合を持つ化合物)がトリアゾールを与える反応が挙げられ、科学分野で積極的に活用されている。
-
- 共役イミン
- イミンは炭素と窒素の二重結合を1つ持つ化合物で、さらに異なる多重結合を併せ持つものを共役イミンと呼ぶ。
-
- ドラッグデリバリーシステム
- 体内の薬物分布を量的・空間的・時間的に制御し、コントロールする薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。
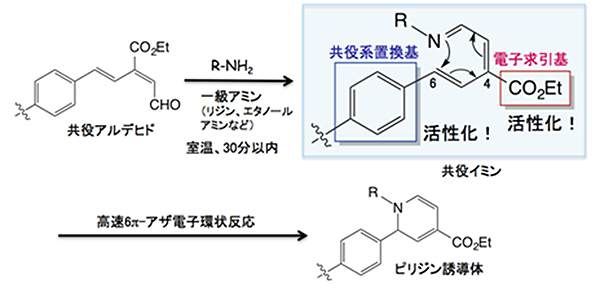
図1 理研クリック反応とその活性化機構
共役アルデヒドと一級アミン(リジンやエタノールアミンなど)を室温で反応させると、30分以内に共役イミンが生成され、理研クリック反応(高速6π-アザ電子環状反応)を引き起こす。その結果、一級アミンとの非可逆的な生成物として環状のピリジン誘導体が得られる。このとき、共役イミンの6位にある共役系置換基(ベンゼン環など)と4位にある電子求引基(-CO2Etなど)の存在が共役イミンを活性化し、理研クリック反応を著しく促進させる。
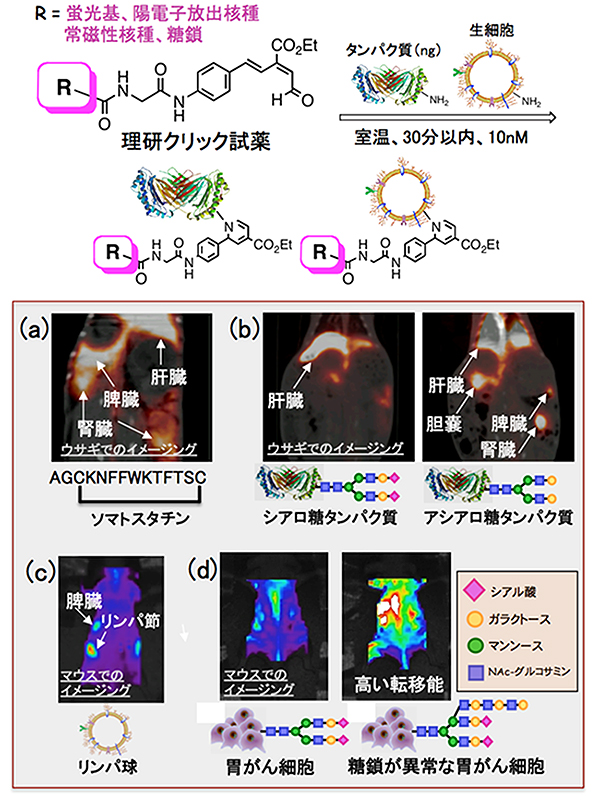
図2 理研クリック試薬によるタンパク質や生細胞の標識化とイメージング
上段: 数ngのタンパク質または生細胞に対して、理研クリック試薬を作用させることで活性を落とすことなくタンパク質や生細胞のアミノ基をさまざまな標識基で標識できる。
下段:
(a)理研クリック試薬を使って陽電子放出核種(68Ga-DOTA)でソマトスタチンペプチドを標識し、ウサギとマウスでPETイメージングを行った。マウスに比べてウサギではソマトスタチンが安定であることが判明し、望む受容体がある脾臓に集まることが明らかになった。
(b)糖鎖の端にシアル酸がある「シアロ糖タンパク質(左)」とシアル酸がない「アシアロ糖タンパク質(右)」に対して、理研クリック試薬を使って68Ga-DOTAで標識し、ウサギでPETイメージングを行った。シアロ糖タンパク質は速やかに肝臓に移行するが、アシアロ糖タンパク質は胆嚢、脾臓、腎臓、肝臓など、あらゆる臓器に集積した。
(c)野生型マウスから取り出したリンパ球の表面を、理研クリック試薬を使って蛍光色素で標識し、別のヌードマウスの静脈に入れて蛍光イメージングを行った。リンパ球が脾臓や腸間膜リンパ節に溜まる様子を可視化できた。
(d)糖鎖構造の異なる胃がん細胞の表面を、理研クリック試薬を使って蛍光色素で標識し、ヌードマウスで蛍光イメージングを行った。2種類の糖鎖のうち、ガラクトースとNAc-グルコサミンの長い糖鎖が余分に結合しているような、糖鎖が異常ながん細胞が、時間経過とともに臓器に取り込まれる様子が観察できた。これは転移能が高いことを示している。
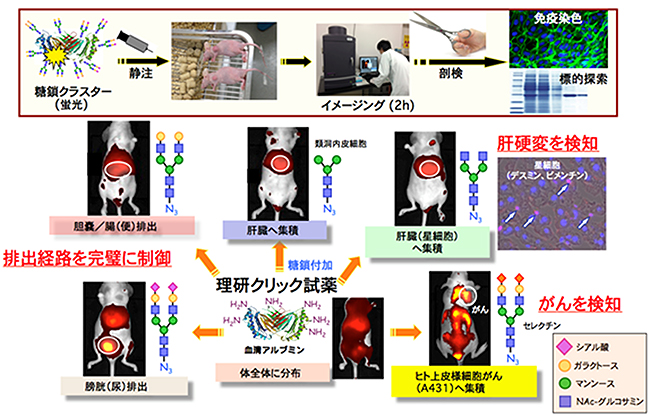
図3 理研クリック試薬を使ったアルブミンへの糖鎖導入と糖鎖構造による動態の制御
蛍光標識した理研クリック試薬を用いて、血清アルブミンタンパク質の表面の10個のリジンのアミノ基に各10分子のさまざまな糖鎖をつけた糖鎖複合体を作製した。これらを用いて、ヌードマウス内での蛍光イメージングを行ったところ、糖鎖構造によって排出経路(胆嚢/腸(便)排出、膀胱(尿)排出)を制御することができた。また、肝臓の類洞内皮細胞へ集積、肝臓の星細胞へ集積・肝硬変を検知した。さらに、ヒト上皮様細胞がんを検知する糖鎖複合化アルブミンの作製に成功した。